2 décembre 2024
 6 min
6 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


5 février 2020
Antibiotiques. La nouvelle classification européenne avantage l'amoxi seule, la doxy et les sulfamides…

L'Agence européenne du médicament (EMA) vient de diffuser fin janvier une nouvelle classification des antibiotiques, critiques ou non critiques, en quatre catégories : de A (antibiotique « à éviter », voire « à proscrire ») à D (antibiotique « de première intention avec un usage prudent »). Elle a été adoptée après que le projet ait été mis en consultation publique il y a tout juste un an, le 5 février 2019 (voir LeFil du 7 février 2019). Elle remplace une ancienne catégorisation de 2013 qui ne comprenant que trois catégories et ne s'intéressait qu'aux antibiotiques classés critiques par l'OMS.
Cette catégorisation quasi exhaustive des antibiotiques existants en 2019 n'a, en soi, aucune valeur contraignante. Elle constitue néanmoins un « point de départ » pour la mise en place de lignes directrices ou de guides de bonnes pratiques en tenant compte aussi de la voie d'administration (orale, injectable, topique) et de l'usage (collectif ou individuel). Car ces deux facteurs ne sont pas pris en compte dans cette catégorisation basée sur les seules molécules et non sur les usages.
En France, la liste française des antibiotiques critiques ne devrait donc pas être modifiée pour tenir compte de cette nouvelle catégorisation (voir LeFil du 29 mars 2016). En France, à ce jour, seules les céphalosporines de dernières générations (C3G/C4G) comme la céfovécine, le ceftiofur, la cefquinome… et les fluoroquinolones en « oxacine » (marbofloxacine, enrofloxacine…) sont concernées par les restrictions d'usage et l'obligation d'un antibiogramme.
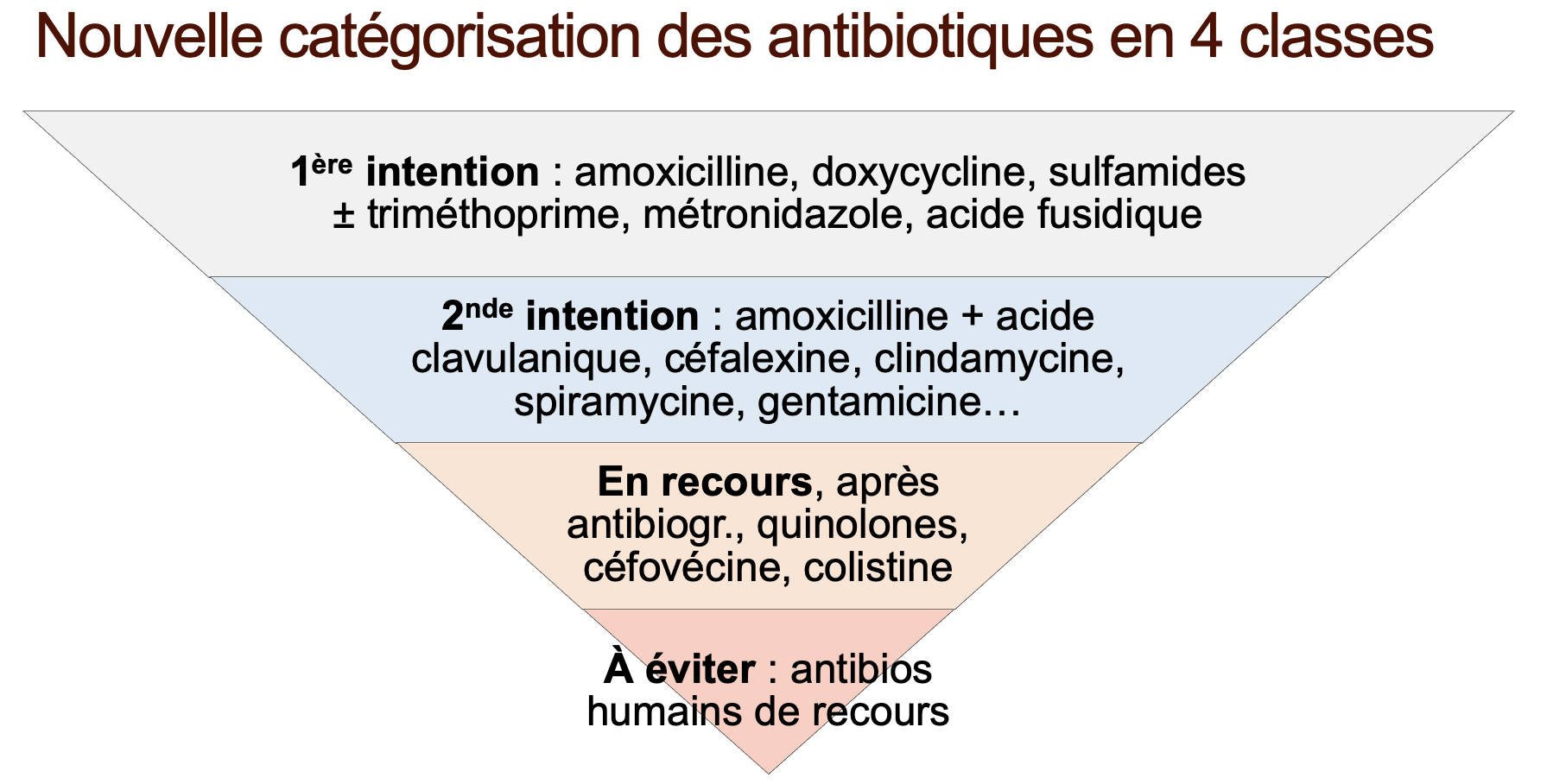
Les antibiotiques sont donc désormais classés en quatre catégories au lieu de trois jusqu'à présent (voir tableau ci-dessous). Les changements de catégories sont marginaux entre le projet mis en consultation et la version finale adoptée par l'Agence européenne du médicament par les comités des médicaments humains et vétérinaires. Les changements sont signalés en rouge dans le tableau ci-dessous.
Nouvelle catégorisation 2020 des antibiotiques pour les usages vétérinaires

Dans ce tableau, les changements sont signalés en rouge et les principaux antibiotiques utilisés chez les animaux de compagnie en gras. D'après EMA.
La catégorie A, « usage à éviter » voire « à proscrire », correspond aux antibiotiques humains de dernier recours sans AMM vétérinaire. Ces interdictions ne devraient pas poser de difficultés d'application en France, puisqu'elles sont déjà, pour la plupart d'entre elles, déjà appliquées depuis 2016 pour une cinquantaine de molécules. Rien de vraiment révolutionnaire jusque-là.
Les rifamycines, notamment la rifampicine, sont désormais classées dans cette catégorie A à l'exception de la rifaximine. La rifampicine, un antibiotique humain utilisé dans le cadre de la cascade, surtout pour la rhodococcose équine, sera donc désormais « à éviter » (voire à proscrire), même chez les chevaux. La rifaximine reste la seule rifamycine classée en catégorie C (usage « avec précautions » en seconde intention). En France, la rifaximine est utilisée seulement dans un intramammaire au tarissement (Fatrox°, Fatro, Vétoquinol).
Plus important, toutes les nouvelles substances actives antibiotiques sont classées, par défaut, dans la catégorie A avec un « usage à éviter chez les animaux ». Dans le cadre d'un nouvel antibiotique avec AMM vétérinaire, il sera aussi classé comme « à éviter » dans l'attente de la révision de cette classification en vue, le cas échéant, de l'inscrire dans une catégorie moins sévère, ou de le conserver en catégorie A.
Cette catégorisation par défaut de tout nouvel antibiotique vétérinaire n'encourage donc pas vraiment le développement de nouvelle molécule. Les industriels ne vont donc pas se battre pour développer de nouvelles molécules classées « à éviter » par défaut, même si les plans EcoAntibio les encouragent à le faire, tout du moins sur le papier.
L'Agence souligne aussi que cette catégorie A ne doit pas formellement être confondue avec la liste des antibiotiques dont l'usage sera interdit en Europe au 28 janvier 2022, en application de l'article 37, §5, du nouveau règlement « médicament vétérinaire » 2019/6 (voir LeFil du 8 janvier 2019). Toutefois, il serait évidemment surprenant que les deux listes ne se recouvrent pas en grande partie.
La catégorie B des antibiotiques dits à « usage restreint » [ou de recours], souvent improprement désignés sous le terme d'antibiotiques « critiques », inclut les céphalosporines de 3° et 4° générations (céfovécine, ceftiofur, cefquinome…), les fluoroquinolones en « oxacine » (marbofloxacine, enrofloxacine…), les autres quinolones (acide oxolinique et fluméquine) et, principalement, la colistine.
En France, ni la colistine, ni la fluméquine ou l'acide oxolinique ne font actuellement partie des antibiotiques critiques. En 2017, les autorités françaises avaient jugé que l'obligation de l'antibiogramme n'était pas adaptée à la colistine. Et les quinolones de premières générations n'avaient jusque-là jamais été considérées comme des molécules critiques par rapport aux fluoroquinolones plus récentes. Elles ne sont d'ailleurs plus beaucoup utilisées. En pratique, ce sont donc les restrictions à appliquer sur la colistine qui seront le plus débattues dans cette liste. Seuls les confrères ruraux seront intéressés et impliqués dans ce débat.
La polymyxine B a curieusement été amalgamée avec la colistine (ou polymyxine E) dans cette catégorie B (« usage restreint »). Mais, en France, la polymyxine B n'est utilisée que dans des topiques ophtalmiques ou auriculaires pour chiens ou chats. Le risque de sélection de résistance est donc très faible, voire négligeable dans ces usages locaux. À l'inverse, la colistine s'utilise majoritairement par voie orale pour des traitements collectifs, avec un risque nettement plus élevé de sélection de résistances qu'avec la polymyxine B. Face aux objections sur cette curieuse inscription, l'Agence européenne du médicament semble avoir parfaitement conscience que la polymyxine B en topiques oculaires ou auriculaires n'a évidemment pas sa place dans cette catégorie B. Mais, contrairement à la classification de 2013, l'Agence n'a pas voulu tenir compte dans cette catégorisation de la voie d'administration pour ne pas trop la complexifier. C'est pourquoi, elle a inclus toutes les polymyxines dans la catégorie B et pas seulement la colistine qui peut aussi être incorporée dans des topiques intramammaires. L'Agence demande toutefois à tenir compte de la hiérarchisation des modes d'administration dans l'appréciation du risque. Elle précise même que l'usage individuel de topiques ophtalmiques ou auriculaires présentent le risque le plus faible de sélection de gènes de résistance, par rapport à tous les autres modes d'administration.
La catégorie C correspond aux antibiotiques à utiliser « avec précautions » en seconde intention, lorsqu'il n'y a pas d'antibiotique présumé efficace dans la première intention (la catégorie D). C'est la principale nouveauté de cette classification européenne par rapport à celle de 2013.
Elle inclut de nombreuses familles d'antibiotiques jusque-là considérées comme non critiques chez les animaux comme la céfalexine, la clindamycine, tous les macrolides, le florfénicol, ainsi que les aminosides comme la gentamicine ou la streptomycine des Peni-Strepto entre autres. Là encore, il conviendrait de modérer le risque pour les nombreux antibiotiques de ces familles qui sont inclus dans des formes topiques, voire injectables.
Point important, l'amoxicilline combinée avec l'acide clavulanique, ainsi que les céphalosporines de premières générations, la céfalexine surtout, sont aussi classées dans ces antibiotiques de « seconde intention ».
Contrairement à la catégorie B, l'Agence européenne ne juge pas nécessaire de préconiser un antibiogramme préalable. Elle ne précise pas quelles précautions pourraient s'appliquer à ces molécules. Elle souligne néanmoins que ces antibiotiques ne devraient être utilisés que dans les cas où les antibiotiques de première intention de la catégorie D ne sont pas efficaces.
Petit changement par rapport au projet de l'an dernier, la spectinomycine, un aminocyclitol apparenté aux aminosides descend dans les antibiotiques de catégorie D de « première intention ». Toutefois, la lincomycine, avec qui la spectinomycine est souvent associée, reste en catégorie C dans les antibiotiques de « seconde intention ». Cela limite donc l'intérêt du changement sur la spectinomycine.
La catégorie D correspond aux antibiotiques non critiques à préférer en première intention à tous les autres : les tétracyclines (doxycycline…), les sulfamides (associés ou non au triméthoprime), l'acide fusidique, ainsi que le métronidazole et le dimétridazole (non associé à la spiramycine). Bonne nouvelle : l'amoxicilline seule (sans acide clavulanique) entre aussi dans cette catégorie des molécules dont l'usage chez les animaux est à « faible risque ».
Cette inscription de l'amoxicilline seule en première intention est toutefois contestée par neuf membres (sur environ 60) des deux comités des médicaments vétérinaire et humain de cette Agence européenne.
Ces experts sont notamment ceux de l'Italie, du Danemark, de la Hongrie, de la Belgique (pour le comité vétérinaire) ainsi que de l'Estonie et de l'Islande (pour le comité des médicaments humains). Ils ont donc signé un avis minoritaire divergent en regrettant que le rapport final ne soit pas suffisamment « protecteur pour la santé publique » en n'appliquant pas assez « le principe de précaution ».
Selon eux, l'amoxicilline sélectionne des résistances BLSE (bêtalactamases à spectre étendu) comme les carbapénèmes classés en catégorie A (« à éviter »). Ils proposent donc de classer l'amoxicilline (et l'ampicilline) dans les antibiotiques critiques (C3G/C4G, quinolones et colistine) de la catégorie B. Son recours serait alors « restreint » en recommandant un antibiogramme préalable pour en justifier l'usage.
L'importante hiérarchie des usages dans l'évaluation des risques
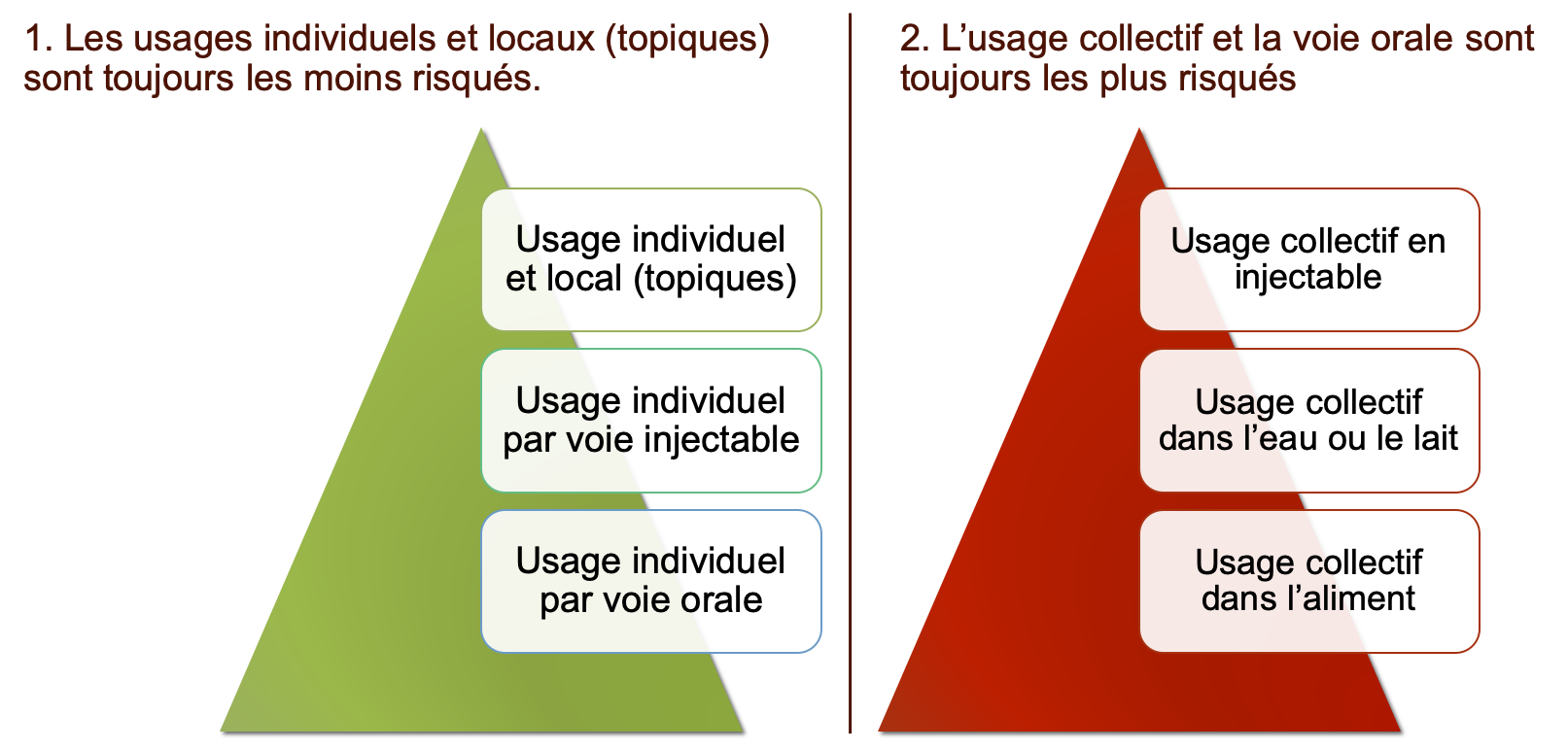
L'Agence européenne du médicament n'a pas voulu tenir compte de la voie d'administration et des usages pour la classification des molécules en quatre catégories. Mais elle souligne qu'il convient de la prendre en compte dans l'application des bonnes pratiques sur le terrain. Les usages locaux, oculaires ou auriculaires sont presque sans risque comparés à la voie orale ou à un usage collectif. D'après EMA.
Intentionnellement, cette catégorisation ne prend pas en compte la voie d'administration ni l'usage collectif ou individuel des antibiotiques. C'est un point important. Car, néanmoins, le document souligne que la voie et le mode d'administration sont à prendre en compte dans l'évaluation du risque de sélection des résistances.
L'EMA propose ainsi la hiérarchie suivante de l'usage le moins sélectionnant à ceux les plus à risque :
Cette catégorisation, même définitivement adoptée, n'est pas figée. Elle devrait être à l'inverse « dynamique », donc « mouvante », pour tenir compte de l'émergence de résistances, comme cela fut le cas pour la colistine en 2016, voire de l'évolution de l'arsenal des antibiotiques vétérinaires disponibles.
L'EMA propose donc une révision périodique, au moins tous les 5 ans, de sa catégorisation.
2 décembre 2024
 6 min
6 min

29 novembre 2024
 5 min
5 min

28 novembre 2024
 3 min
3 min

27 novembre 2024
 4 min
4 min

26 novembre 2024
 5 min
5 min






25 novembre 2024
 5 min
5 min
