2 décembre 2024
 6 min
6 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.

27 juin 2019
Médicaments Canada Dry. Où est la frontière entre l'aliment-gélule qui soigne et le médicament…


« Ça a l'aspect d'un médicament, le goût du médicament. Son nom sonne comme un nom de médicament… Mais ce n'est pas un médicament ». Ou alors c'est un médicament Canada Dry comme aurait dit la publicité pour cette boisson qui a la couleur et le goût de l'alcool mais qui est sans alcool.
L'Agence nationale du médicament vétérinaire (Anses-ANMV) est régulièrement questionnée par des industriels, des vétérinaires, des services de l'État… sur le statut des produits frontières — ou Canada Dry — par rapport à celui du médicament vétérinaire. Elle vient de diffuser une note de position datée du 22 mai sur le statut juridique de ces produits borderline. Elle avait déjà diffusé une note de ce type en septembre 2013 sur ceux à base de plantes. La nouvelle note a été élaborée conjointement avec les ministères de l'agriculture (DGAL), de la santé (DGS), de l'écologie (impliqué dans les biocides) et surtout les fraudes (DGCCRF) en charge, entre autres, du contrôle des aliments pour animaux. Cette note en gagne évidemment en intérêt et en « valeur contraignante ». L'administration fiscale se prononce aussi sur la requalification comme « médicament vétérinaire » (soumis à la TVA 20 %) de certains aliments pour animaux litigieux vendus à la TVA réduite (10 %). Des rappels de TVA sur les aliments litigieux requalifiés en médicaments sont exigés par les services fiscaux. L'administration fiscale n'a pas été consultée sur cette note.
L'enjeu est d'importance, voire crucial pour certains produits frontières et leurs fabricants. L'AMM, délivrée par cette agence, est requise pour les médicaments vétérinaires alors que la plupart des produits frontières, notamment les aliments complémentaires pour animaux, ne sont pas du tout évalués préalablement à leur commercialisation.
Indépendamment du coût et du délai des études d'innocuité et d'efficacité nécessaires à l'octroi d'une AMM, certains produits borderline ne peuvent pas présenter pas une qualité analytique suffisante et constante pour répondre à des exigences de type Pharmacopée. La formulation d'un aliment n'est en effet pas constante mais peut varier d'un lot à l'autre, par exemple dans l'origine et la composition des matières premières. Ces variations ne sont évidemment pas acceptées pour un médicament avec AMM.
Qualifier des produits frontières de médicaments vétérinaires (soumis à AMM) revient donc parfois, souvent même, à en interdire définitivement la commercialisation.
En outre, un médicament vétérinaire avec AMM est nécessairement fabriqué et distribué par des entreprises pharmaceutiques autorisées par l'Anses-ANMV : fabricants, exploitants, distributeurs en gros… Cela n'est pas exigé pour les produits frontières ne relevant pas de ce statut. Ces établissements sont soumis à des exigences plus élevées (comme des inspections et des états annuels), non seulement sur les médicaments vétérinaires, mais aussi sur l'ensemble de son activité même non pharmaceutique. Par exemple, le dispositif anti-cadeaux ou sur la transparence des conventions s'applique à toutes les activités et produits de l'entreprise, même si une majorité de ses produits sont des vrais aliments qui ne relèvent pas du statut de médicament.
Sauf pour les antipuces dérogatoires, les médicaments, même sans ordonnance obligatoire, ne peuvent être revendus aux détenteurs des animaux que par des ayants droit : les vétérinaires, les pharmaciens et, le cas échéant, les groupements agréés. L'Ordre des pharmaciens est donc très actif pour faire requalifier en médicament (humain) des produits frontières qui sortent du monopole des officines. Et quasi systématiquement, l'Ordre des pharmaciens gagne ces procès. La jurisprudence est donc beaucoup plus favorable au statut de médicament — qui protège mieux la santé publique — qu'aux autres statuts.
La publicité et leur promotion des médicaments vétérinaires sont aussi très encadrées par rapport à celles des produits frontières. La publicité est interdite auprès du public pour les médicaments sur prescription et soumise à l'autorisation de l'Anses-ANMV pour ceux non soumis à ordonnance.
En outre, « il est interdit de solliciter auprès du public des commandes de médicaments par tout moyen et de satisfaire de telles commandes » (art. L. 5143-6 du code de la santé publique).
Enfin, le taux de TVA des médicaments vétérinaire est de 20 % alors que celui des aliments pour animaux dits du bétail (chevaux inclus) est de 10 %.
Contrairement aux idées reçues, ce n'est pas l'AMM qui qualifie un médicament. Mais c'est parce qu'un produit répond à la définition du médicament que l'AMM devient obligatoire lorsqu'il est préparé par un industriel. Cette définition étant commune au médicament humain et vétérinaire (art. L. 5111-1 du code de la santé publique), l'abondante jurisprudence relative à la pharmacie humaine peut s'appliquer à la santé animale. Le médicament est défini par sa présentation et/ou par sa fonction.
Le médicament par présentation comprend « toute substance ou composition [tout produit] présenté comme possédant des propriétés curatives ou préventives à l'égard des maladies animales ». C'est donc la présentation explicite (une allégation thérapeutique claire) ou implicite qui fait que le produit est qualifié de médicament.
L'agence rappelle une jurisprudence européenne ancienne (1983) sur le médicament humain sur ce point. Un produit relève du statut de médicament « s'il apparaît, de manière même implicite mais certaine, aux yeux d'un consommateur avisé, que ce produit devrait — eu égard à sa présentation — avoir un effet curatif ou préventif ».
D'autres jurisprudences nationales ou européennes confortent ce point sur la présentation implicite d'un produit comme un médicament sur la base de plusieurs indices concordants aux yeux du consommateur, comme la forme galénique, un conditionnement de type pharmaceutique (blister), la présence d'un caducée, d'une croix verte, des mentions de type « conçu ou fabriqué sous contrôle pharmaceutique » ou « issu de la recherche pharmaceutique, médicale ou, par extension vétérinaire », la vente par un laboratoire pharmaceutique connu ou dont le nom contient le terme « pharma », l'usage de termes médicaux de type « cure, diagnostic, thérapie, signes cliniques, maladies », la distribution en pharmacies (ou par extension, chez le vétérinaire)… On pourrait sans doute y ajouter le nom commercial du produit. Ce n'est souvent pas un seul de ces critères qui conduit à classer le produit comme un médicament, mais la combinaison de plusieurs d'entre eux qui le font apparaître assez clairement comme un médicament aux yeux du consommateur.
Ainsi le sucre est bien un aliment. Mais, dès lors qu'il s'agit d'un granule d'homéopathie fabriqué par Boiron, il n'y a pas de doute. Cette présentation homéopathique en fait un médicament. On pourrait multiplier les exemples de ce type avec les plantes médicinales qui sont aussi des épices ou des condiments alimentaires.
Le médicament par fonction est défini comme tout produit « pouvant être utilisé chez l'animal ou pouvant leur être administré, en vue d'établir un diagnostic médical ou de restaurer, corriger ou modifier leurs fonctions physiologiques en exerçant une action pharmacologique, immunologique ou métabolique. » C'est donc bien ici la fonction, l'objectif recherché par son usage chez l'animal, qui fait du produit un médicament.
L'huile de paraffine n'est pas a priori un médicament. Mais dès lors qu'elle est utilisée chez l'animal pour ses propriétés laxatives, il le devient ! Le médicament par fonction est donc celui, qui, entre autres, par sa composition en substances (actives) a une activité pharmacologique curative ou préventive…, même si cet effet n'est pas nécessairement revendiqué.
L'Agence se prononce « au cas par cas » en fonction de « l'ensemble des caractéristiques » du produit litigieux : sa composition, ses propriétés pharmacologiques en l'état actuel des connaissances, le mode d'emploi chez l'animal, l'ampleur de la diffusion, la connaissance des consommateurs et aussi les risques liés à son usage.
Enfin, la réglementation précise aussi qu'en cas de doute entre deux statuts, le produit litigieux relève du statut du médicament dans un but de protection de la santé publique.
Le nouveau règlement « médicament vétérinaire » (2019/6) prévoit aussi que si un produit relève à la fois du statut de médicament et de celui de produit biocide ou d'additif pour l'alimentation animale, c'est la réglementation sur le médicament vétérinaire qui prévaut (art. 3).
D'ailleurs, le doute est tel que dans les statistiques de ventes, voire dans certains catalogues des centrales d'achats, tous ses produits frontières sans AMM dont la finalité reste de soigner les animaux sont comptabilisés comme des ventes de médicament vétérinaire…
L'Agence du médicament vétérinaire identifie au moins six statuts autres que le médicament pour ces produits frontières :
Exemples de produits frontières avec le statut de médicament
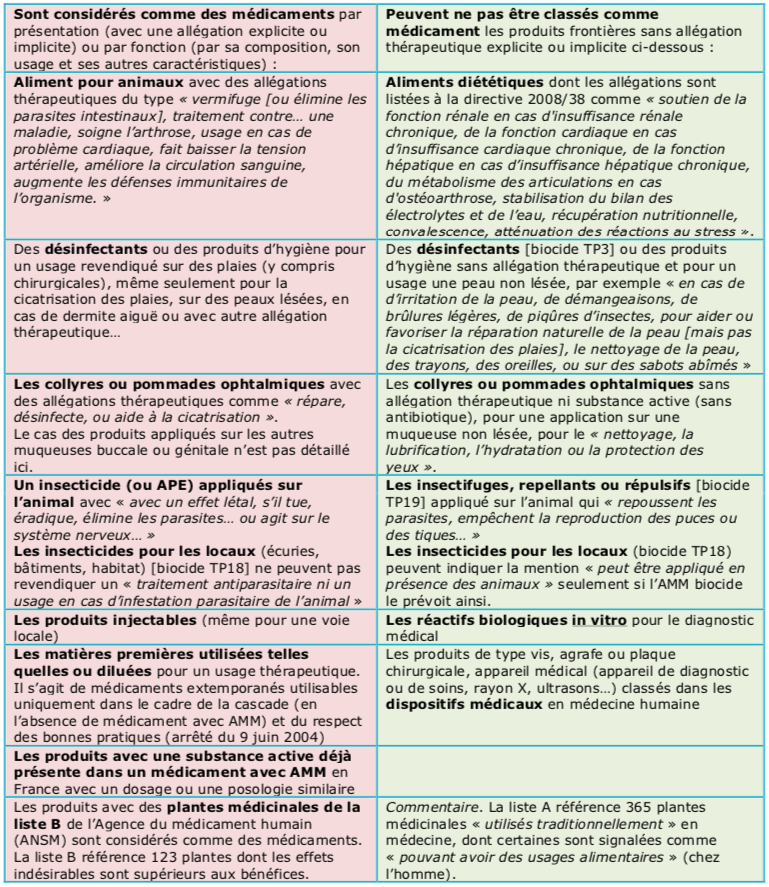
C'est dans les allégations que l'Agence donne le plus d'exemples de frontières entre les médicaments et les autres statuts. Aucune allégation thérapeutique, explicite ou implicite, directe ou indirecte, n'est permise pour des produits qui n'ont pas le statut de médicament.
Ainsi, des aliments pour animaux ne peuvent pas « traiter une maladie », « ni soigner l'arthrose » avec des GAG, ni même être recommandé en cas de « problème cardiaque », ni « pour augmenter les défenses immunitaires ».
En revanche, la réglementation sur l'alimentation animale prévoit que des aliments puissent être dotés d'allégations dites diététiques ou « à objectif nutritionnel particulier » qui se rapproche parfois beaucoup d'allégations thérapeutiques. Ces allégations figurent dans une liste « fermée » publiée dans la directive européenne 2008/38 (voir ce lien). Les aliments doivent non seulement respecter le libellé de l'allégation diététique, mais aussi les caractéristiques nutritionnelles associées. Ainsi, il n'est pas prévu que des aliments à base de pansements digestifs puissent revendiquer « une stabilisation du bilan des électrolytes et de l'eau ». Cette allégation correspond seulement aux « réhydratants oraux » vendus sous le statut des aliments complémentaires.
De même, le « soutien de la fonction cardiaque en cas d'insuffisance cardiaque chronique » correspond seulement à des aliments hyposodés, etc.
Pour l'Agence du médicament, les produits désinfectants ou cicatrisants qui sont étiquetés comme « à utiliser sur des lésions cutanées, des plaies, y compris des plaies chirurgicales » ne peuvent être que des médicaments vétérinaires (avec AMM).
À l'inverse, des désinfectants biocides vétérinaires (de TP3 dans le jargon réglementaire) peuvent désinfecter des peaux saines, des oreilles, des trayons comme les nombreux produits de trempage mammaire autorisés. L'Agence du médicament accepte que ces topiques puissent revendiquer « d'être appliqués en cas de d'irritation de la peau, de démangeaisons, de brûlures légères, de piqûres d'insectes, pour favoriser la réparation ou la régénération naturelle de la peau [mais la cicatrisation d'une plaie] ou, sur des sabots abîmés ».
En revanche, pour les yeux, la simple désinfection n'est une allégation permise que pour des médicaments (stériles) avec AMM, contrairement aux produits de « nettoyage, de lubrification ou d'hydratation des yeux » qui peuvent rester « sans AMM ».
Les produits insectifuges ou répulsifs ou répulsifs administrés à l'animal, sous forme de spot-on ou de spray, peuvent être classés comme des biocides répulsifs (TP19) s'ils en comportent aucune allégation thérapeutique de type « antiparasitaire ». Par contre, ils peuvent repousser les mouches, les moustiques, voire les puces ou les tiques ou d'autres arthropodes…, mais « sans les tuer, les éliminer ni les éradiquer ». Ces produits biocides ne peuvent pas non plus faire référence à la lutte contre des maladies vectorielles.
« Une action létale, insecticide ou acaricide, sur le parasite implique la classification en médicament vétérinaire ». Les biocides insecticides ou acaricides (TP18) (action létale) ne peuvent donc pas traiter des animaux mais « du matériel ou des locaux ». Ces insecticides ne peuvent pas non plus mentionner qu'ils peuvent être appliqués en présence des animaux sauf si leur autorisation comme biocide a prévu cet usage. La quasi-totalité des produits anti-mouches pour chevaux sont pourtant dans cette catégorie des biocides insecticides interdits d'application cutanée. Ce qui n'est évidemment pas respecté !
Quelle que soit leur composition, tous les produits administrés par voie injectable sont classés comme des médicaments, même s'ils sont destinés à une voie locale comme des injections intra-articulaires chez les chevaux. Les solutés injectables de NaCl 0,9 % ou de glucose sont même classés désormais en liste I des substances vénéneuses. Alors que l'eau salée ou sucrée ne l'est évidemment pas !
Le cas des matières premières qui peuvent être achetées en centrales est plus intéressant, par exemple l'huile de paraffine, la vaseline, le sorbitol, a fortiori l'acide ascorbique ou l'aspirine.
L'Agence rappelle que l'usage pharmaceutique des matières premières est « présumé dès lors qu'elles sont cédées à un pharmacien d'officine ou à un vétérinaire » (art. L. 5138-2) sauf si le vétérinaire peut justifier d'un autre usage, par exemple cosmétique pour la vaseline ou nutritionnel pour l'acide ascorbique (vitamine C).
Si le vétérinaire revend en l'état, diluées ou divisées… ces matières premières à usage pharmaceutique (MPUP), « les produits cédés sont alors qualifiés de médicaments ». Cet usage n'est possible que sur prescription dans le cadre de la cascade. Ces médicaments sans AMM devraient alors suivre les règles d'étiquetage des préparations extemporanées. Au minimum, le cachet du vétérinaire doit être apposé sur l'emballage avec la posologie, le mode d'emploi et la mention « usage vétérinaire »
En outre, les établissements qui distribuent ou fabriquent les MPUP doivent y être autorisés par l'Agence du médicament humain (ANSM).
2 décembre 2024
 6 min
6 min

29 novembre 2024
 5 min
5 min

28 novembre 2024
 3 min
3 min

27 novembre 2024
 4 min
4 min

26 novembre 2024
 5 min
5 min






25 novembre 2024
 5 min
5 min
