11 avril 2025
 3 min
3 min
Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.


26 septembre 2017
Refonte européenne sur le médicament. Les négociations débutent en 2018 pour une adoption début 2019 et une application en… 2022
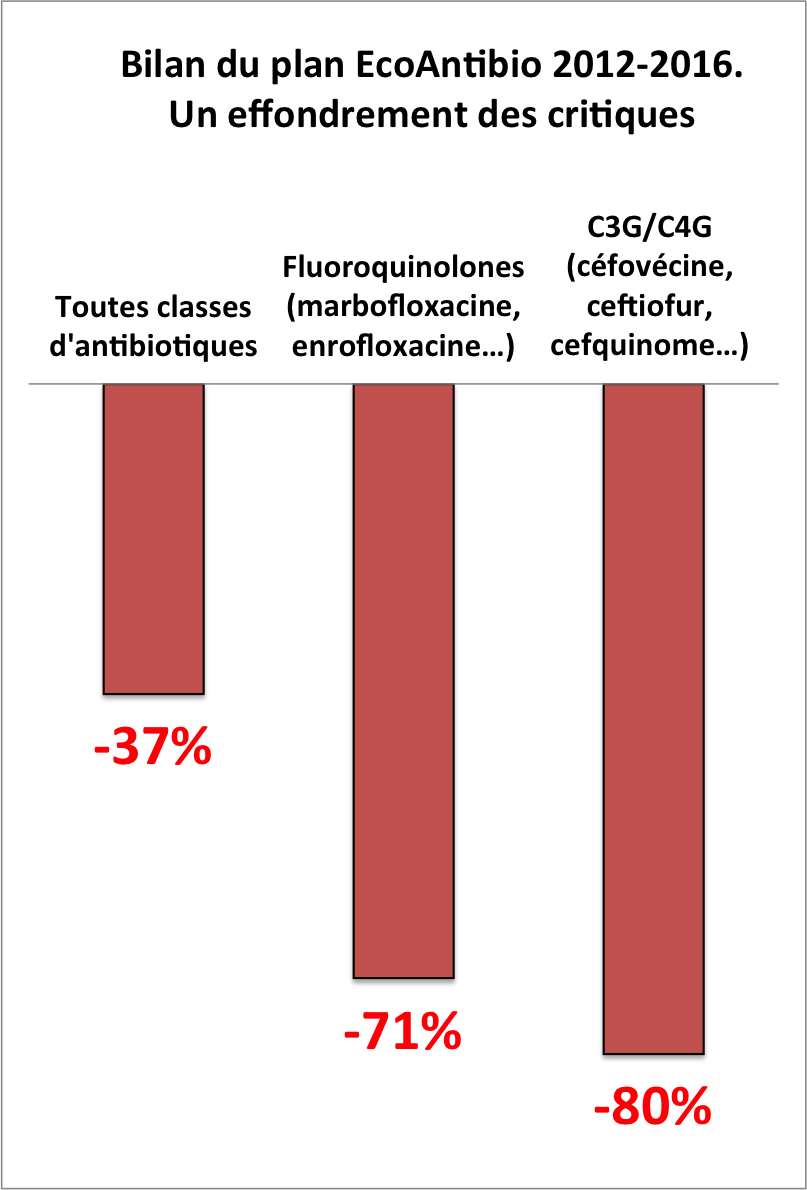
Ce n'est plus une réduction mais une hécatombe. Les céphalosporines de dernières générations (C3G/C4G) se sont écroulées : -80 % en trois ans. Tous comme les fluoroquinolones : -71 %. Et toutes classes confondues, les antibiotiques ont chuté de 37 % en cinq ans. En avant-première, l'Agence nationale du médicament vétérinaire (Anses-ANMV) a dévoilé le 21 septembre le bilan final du plan EcoAntibio 2012-2016 lors de sa première journée de l'ANMV devant un public d'environ 120 à 150 personnes, plus d'une centaine d'industriels et une vingtaine de vétérinaires praticiens, entre autres.
Les objectifs d'une réduction de 25 % du plan EcoAntibio1 2012-2016 sont donc très largement dépassés en tenant compte des dernières données de 2016. La loi d'avenir avait fixé un objectif de « moins 25 % » en trois ans (2014, 2015, 2016) pour les C3G/C4G (céfovécine, ceftiofur et cefquinome) et les fluoroquinolones (marbofloxacine, enrofloxacine…). Avec de tels résultats, le plan français a obtenu un satisfecit remarqué de la Commission européenne. Il est loin, très loin, le temps où les pharmaciens pouvaient prôner le découplage en dénonçant l'éternel conflit d'intérêts des vétérinaires à la fois prescripteurs et vendeurs des antibiotiques.
D'autres actualités importantes étaient au menu de cette journée de l'ANMV, comme la refonte de la réglementation européenne du médicament vétérinaire, le Brexit, la phytothérapie…
Le projet de règlement européen sur le médicament vétérinaire avance à la vitesse d'une tortue : lentement mais sûrement. Quand il sera applicable, sans doute vers 2022, ce règlement annulera et remplacera une grande partie de nos dispositions nationales, sur les AMM, la prescription et même la distribution. Surtout, en 2022, il sera trop tard pour négocier. L'avenir se prépare donc dès maintenant sur le médicament vétérinaire.
Car ce règlement devrait en effet être voté avant les prochaines élections d'un nouveau parlement européen du printemps 2019.
Trois ans d'adaptation sont ensuite prévus avant son application vers 2022 sans transposition en droit national. Le projet initial prévoyait un délai de deux ans. Devant l'importance de cette refonte, ce délai a été porté à trois ans à la demande du Conseil.
L'idée de cette refonte a été lancée par la présidence française de l'UE fin 2008. Le 16 septembre 2014, le projet de texte a été publié par la Commission européenne. Puis le 10 mars 2016, 258 amendements ont été adoptés par le Parlement européen (voir LeFil du 11 mars 2016).
Depuis le 10 mars 2016, le projet est entre les mains du Conseil européen qui représente les gouvernements des États membres (voir LeFil du 8 août 2017). Les « experts techniques nationaux » du Conseil Européen viennent juste d'en terminer sa réécriture complète. Cette version doit être adoptée au niveau des ministres du Conseil européen.
L'année 2018 sera ensuite consacrée au « trilogue » avec des discussions entre le Conseil, le Parlement et la Commission européenne. L'objectif du trilogue serait d'aboutir à un texte final consensuel à la fin de l'année 2018 ou au début 2019. Le Parlement pourrait ainsi le voter avant son renouvellement prévu en mai 2019.
Sur le fond, des modifications significatives ont déjà été apportées par les experts du Conseil.
Autre sujet d'actualité pour l'agence française : le Brexit. Car d'ici au 30 mars 2019 au matin, les 670 médicaments européens gérés par l'agence britannique, soit un tiers des AMM européennes, devront avoir été relocalisés dans l'UE27. Depuis vingt ans, l'agence britannique (VMD) a su séduire de nombreux laboratoires de lui confier l'évaluation et la gestion de leurs AMM en choisissant le Royaume-Uni comme État membre de référence dans les procédures européennes d'AMM décentralisées ou en reconnaissance mutuelle.
L'ANMV se montre attractive et impliquée pour qu'une partie significative de ces AMM soit relocalisée en France. Pour absorber l'importante charge de travail supplémentaire, le directeur général de l'Anses évoque un accroissement des effectifs et des moyens dévolus à l'Agence du médicament vétérinaire.
Avec 279 AMM européennes déjà gérées par l'ANMV, la France est aujourd'hui le troisième pays choisi comme État membre de référence derrière l'Irlande (363 AMM). Sur les 670 AMM encore localisées au Royaume-Uni, 438 sont déjà valables en France comme État membre concerné.
L'ANMV constate aussi, comme les vétérinaires, un « fort engouement » pour les produits présentés comme des alternatives aux antibiotiques. Il n'y a toutefois pas de définition claire de ces produits qui appartiennent à de nombreuses classes : autovaccins, phytothérapie, peptides, bactériophages, immunomodulateurs etc.
L'agence rappelle que l'évaluation de ces produits devrait reposer une analyse « bénéfice/risque ». Si l'allégation « alternative aux antibiotiques » est revendiquée, il conviendrait de la prouver par des essais comparatifs contre une antibiothérapie, une réduction démontrée de l'usage des antibiotiques et une vérification de l'absence d'impact négatif sur le transfert ou la dissémination des résistances.
Sur la phytothérapie, un allégement des exigences AMM est déjà possible surtout en termes d'innocuité et d'efficacité avec un recours envisageable à une bibliographie. Même avec ces allégements, aucun dossier d'AMM n'a été déposé à l'ANMV. Trois freins sont identifiés : l'identification stricte des substances actives, l'absence de bibliographie de bonne qualité, et, en productions animales, l'obligation de disposer d'une limite maximale de résidus (LMR).
En outre, face à la forte concurrence des produits « phyto » sans AMM en vente libre sur le terrain, les industriels ne voient pas l'intérêt d'investir dans des médicaments avec des AMM plus contraignantes. L'engouement et la multiplicité de ces produits phyto sans AMM laissent les vétérinaires dubitatifs, mais pas indifférents. Ils souhaiteraient disposer de davantage de garanties sur ces produits, mais sans doute pas les voir tous disparaître.
L'agence rapporte une montée en puissance des contentieux sur les produits frontières, dès lors que ces produits relèvent du statut des médicaments avec AMM, notamment du fait de leurs allégations.
À l'intention des vétérinaires, l'agence rappelle l'existence de son nouveau site web pour faciliter les télédéclarations des cas de pharmacovigilance et leur suivi, évolution vers la guérison ou non, ajout de fichiers en annexe… (Voir ce lien).
Et, plutôt à l'intention des industriels, l'agence signale qu'il est possible de paramétrer son compte Anses pour recevoir les informations et les alertes sur le médicament vétérinaire à partir de ce lien.
11 avril 2025
 3 min
3 min

10 avril 2025
 7 min
7 min

9 avril 2025
 5 min
5 min

8 avril 2025
 5 min
5 min

7 avril 2025
 5 min
5 min

4 avril 2025
 4 min
4 min
