3 décembre 2024
 5 min
5 min

Bienvenue sur LeFil.vet
L'accès au site web nécessite d'être identifié.
Merci de saisir vos identifiants de connexion.
Indiquez votre email dans le champ ci-dessous.
Vous recevrez un email avec vos identifiants de connexion.

4 décembre 2024
Les E. coli uropathogènes canines se portent d'autant mieux qu'Enterococcus faecalis est aussi présent

Lors d'infections urinaires canines, il n'est pas rare que la bactériologie rende un résultat de co-infection, avec la présence d'E. coli et d'Enterococcus faecalis (EF). Cette association de malfaiteurs résulte-t-elle d'une coïncidence, d'une compétition pour une même niche écologique (l'appareil urinaire) ou d'une coopération entre deux espèces de Gram opposé ? Des microbiologistes et épidémiologistes vétérinaires de l'université de Raleigh (USA) viennent d'apporter une réponse : la présence d'EF favorise la croissance d'E. coli, mais seulement si la souche est équipée d'un plasmide particulier (de conjugaison).
Les E. coli sont des entérobactéries, mais certaines populations de cette espèce ne nichent pas dans le système digestif : elles se sont adaptées à d'autres niches, extra-intestinales. Ces E. coli extra-intestinales sont souvent nettement pathogènes, d'où leur nom d'ExPEC (pour Extra-intestinal Pathogenic E. coli). Elles sont responsables de cystites et d'infections urinaires récurrentes chez le chien comme l'humain, et sont alors nommées UPEC (Urinary Pathogenic E. coli). Il n'y a pas un seul clone d'UPEC : ce sont souvent des populations diverses, y compris génétiquement. Elles sont dépendantes du fer pour leur croissance, et en son absence, elles sécrètent des exopolysaccharides (composants de la paroi), qui la protègent des agresseurs (peptides antimicrobiens et complément), en même temps que quatre complexes moléculaires indépendants, tous impliqués dans la captation du fer du lilieu extérieur (sidérophores). De son côté, EF est une bactérie possédant une résistance antimicrobienne intrinsèque importante, des facteurs moléculaires lui permettant l'évasion immunitaire, et est capable de produire des biofilms robustes, qui la mettent à l'abri des concentrations thérapeutiques en antibiotiques, par exemple dans la vessie.
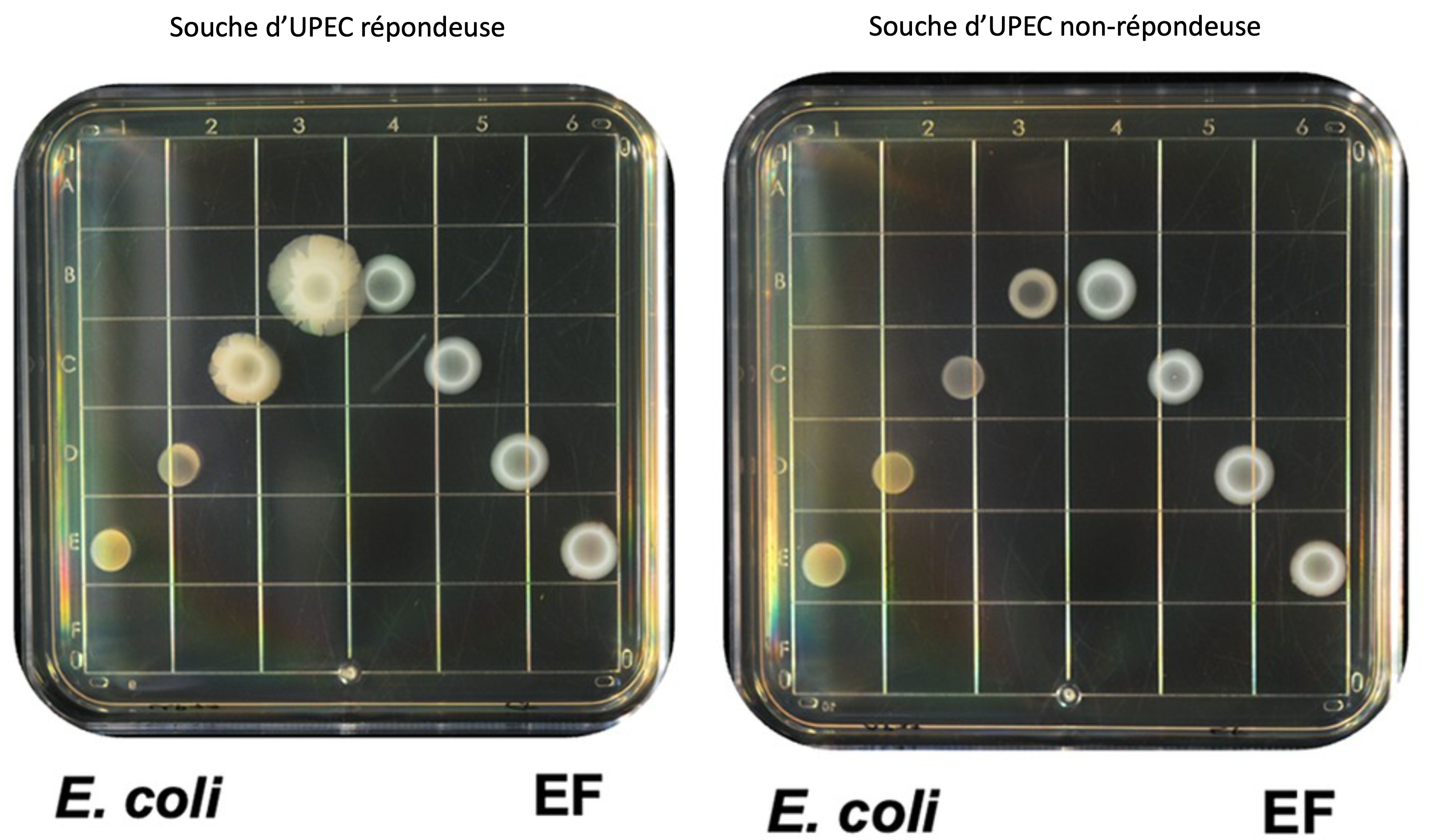
Pour explorer la nature de la relation de croissance entre les deux espèces bactériennes, les auteurs ont utilisé 11 souches d'E. coli isolées à partir de cas d'infection urinaire chez le chien (UPEC), et dont la bactériologie avait aussi montré la co-infection avec EF. Ils ont ensuite cultivé chacune de ces 11 souches en présence d'une seule et même souche d'EF. Les souches d'UPEC ont d'abord été ensemencées seules avec la présence d'un chélateur du fer dans le milieu. En parallèles, elles ont été ensemencées dans les mêmes conditions, mais avec présence plus ou moins proche (voir l'illustration principale) d'EF sur la gélose. Le même essai a été réalisé sans chélateur de fer : c'est seulement lorsqu'il est présent que 10 des 11 UPEC ont une croissance nettement supérieure à proximité d'EF, passant de 102,6 UFC/g sans EF à > 104,6 UFC/g en “coculture” (soit une croissance améliorée d'un facteur 100, p<0,01).
La totalité du génome de ces 12 souches a été séquencée et les auteurs ont réalisé un arbre phylogénétique pour les UPEC : elles appartiennent à 4 groupes génétiques différents (A, B1, B2 et C). Et certaines de ces souches appartiennent aux mêmes groupes que des E. coli ExPEC d'origine aviaire (poulets d'élevage). En comparant la souche d'UPEC canine qui répond le mieux en présence d'EF à la souche qui répond le moins, les auteurs identifient qu'il y a 75 protéines chez la première qui sont absentes de la seconde, dont :
Pour évaluer si ces propriétés ont un rôle sur la pathogénicité, les auteurs ont donc inoculé des embryons de poulet avec soit une souche “répondeuse” (ayant mieux poussé en présence d'EF et donc ayant produit une capsule), soit une souche “non répondeuse”. Alors que les souches d'UPEC initiales sont peu virulentes (pas de mort de l'embryon), la souche “répondeuse” (c'est-à-dire ayant mieux poussé à proximité d'EF) cause une proportion significativement plus élevée (p<0,05) de décès de l'embryon. L'autre souche (non répondeuse) n'augmente pas le taux de mortalité par rapport à l'inoculum initial. Retournant à l'analyse génomique, les auteurs observent que si toutes les souches d'UPEC ont bien un plasmide de conjugaison, chez les souches répondeuses celui-ci est possède aussi le gène de l'aérobactine (l'un des sidérophores d'E. coli), tandis que chez la souche non répondeuses, il lui manque un gène essentiel pour faire cette conjugaison — et celui de l'aérobactine. Lorsqu'ils retirent ces deux gènes du plasmide d'une souche répondeuse, elle devient alors non-répondeuse. « C'est la première fois que des déterminants génétiques de la coopération » entre les deux espèces bactériennes sont identifiés.
Les résultats du typage des UPEC « suggèrent que cette synergie de croissance au cours de la co-infection est un phénomène commun et répandu, qui ne se limite pas à des souches particulières [clonales] d'ExPEC ou d'EF ». La présence d'EF (lors de co-infection) activerait :
Au bilan, les auteurs soulignent que « l'importance clinique de l'augmentation de la virulence des ExPEC par EF en cas de co-infection doit être prise en compte » par les praticiens. Et comme les UPEC canines peuvent appartenir aux mêmes groupes génomiques que les E. coli pathogènes aviaires, il est légitime de s'interroger sur le rôle que pourrait jouer la viande de poulet crue dans la contamination des chiens recevant un régime BARF…
3 décembre 2024
 5 min
5 min

2 décembre 2024
 6 min
6 min

29 novembre 2024
 5 min
5 min

28 novembre 2024
 3 min
3 min

27 novembre 2024
 4 min
4 min
